 دید کلیشیمی کوانتومی ، دانش کاربرد مکانیک کوانتومی در مسایل مربوط به شیمی است. اثر شیمی کوانتومی ، در شاخههای وابسته به شیمی قابل لمس است. مثلا :
فرضیه پلانک ، سرآغاز مکانیک کوانتومیدر سال 1900، "ماکس پلانک" ، نظریهای ابداع کرد که با منحنیهای تجربی تابش جسم سیاه
، مطابقتی عالی از خود ارائه داد. فرض او این بود که اتمهای جسم سیاه (
مادهای که تمام نورهای تابیده به آن را جذب کند ) ، تنها قادرند نورهایی
را گسیل سازند که مقادیر انرژی آنها توسط رابطه hv داده میشود. در رابطه ،
v فرکانس تابش و h ، ثابت تناسب است که به ثابت پلانکمعروف است. با قبول
مقدار احتمال و مکانیک کوانتومیموضوع احتمال
، یک نقش اساسی را در مکانیک کوانتومی ایفا میکند. در مکانیک کوانتومی ،
سروکار ما با احتمالاتی است که با متغیر پیوستهای مانند مختصه x درگیرند.
صحبت از احتمال پیدا شدن یک ذره در یک نقطه خاص مانند x = 0.5000 حاوی
چندان معنایی نیست، زیرا تعداد نقطهها در روی محور xنامتناهی ، ولی تعداد
در اندازه گیریهای ما به هر حال متناهی است و از این رو ، احتمال وصول با
دقت به 0.5000 بینهایت کم خواهد بود. اصل عدم قطعیت هایزنبرگاندیشه "بوهر" مبنی بر اینکه هر الکترون در اتم
، تنها میتواند کمیتهای معین انرژی را دارا باشد، گام مهمی در رشد و
تکوین نظریه اتمی بود (مدل اتمی بوهر). نظریه بوهر برای توجیه طیف اتم
هیدروژن ، مدلی رضایت بخش ارائه کرد، اما تلاش برای بسط نظریه به منظور
تشریح طیف اتمهای دارای بیش از یک الکترون ناموفق بود. دلیل این مشکل به
زودی آشکار شد. |

دانلود پرفروش ترین فایل ها# فورکیا # اینترنت#فایل سل#
فایل های پرفروش فورکیا و اینترنت را دانلود کنید(فایل های در این وبسایت قرار داده می شودکه تضمینی و مطمئن هستن ،اگر غیر از این بود به مدیریت اطلاع دهید)سعی شده فایل های دارای ضمانت معتبر گلچین بشه ولی تصمیم با شماست.موفق باشید
شما در این سایت میتوانید به راحتی بهترین فایل ها که دارای ضمانت می باشند را دانلود کنید(فایل سل،فورکیا،همیار دانشجو و....)
بهترین های اینترنت را در این وب سایت بیابید.
بهترین های اینترنت را در این وب سایت بیابید.
بایگانی
- ارديبهشت ۱۳۹۷ (۲)
- دی ۱۳۹۶ (۱۰۳)
- مهر ۱۳۹۶ (۱۱۵۱)
- شهریور ۱۳۹۶ (۲۸۲۸)
- مرداد ۱۳۹۶ (۱۶۷۸)
- تیر ۱۳۹۶ (۷۰)
- خرداد ۱۳۹۶ (۹۵)
- فروردين ۱۳۹۶ (۹)
- اسفند ۱۳۹۵ (۴۸)
- بهمن ۱۳۹۵ (۴۰)
آخرین مطالب
- ۹۷/۰۲/۲۵آژانس مسافرتی پرواز سیر
پیوندهای روزانه
طبقه بندی موضوعی
-
کتاب،جزوات رایگان
(۱۶۲)-
نمونه سوال
(۲۵) -
نمونه سوالات فنی حرفه ای
(۴)
-
-
لوازم یدکی شبکه های اجتماعی
(۲۶۰) -
پایان نامه، مقاله و پروژهای دانشجویی
(۳۳۰) -
نرم افزار(اندروید وpc)
(۵۴۶)-
پزشکی
(۱۸) -
بازی
(۱۷) -
برنامه نویسی،سورس،پروژه
(۳۱۷) -
نرم افزارهای آماده
(۱۸۶)
-
-
کسب درآمد(میلیونر شو)
(۶۱۴)-
کسب و کار اینترنتی
(۱۸۸) -
کارآفرینی,طرح توجیهی
(۳۱۲) -
استخدامی
(۶۴) -
سایر موضوعات کسب و کار
(۱۱۵) -
تجارت
(۴۳)
-
-
پرشنامه
(۳۴) -
کتاب و کلاسهای آموزشی
(۲۶۴)-
کتاب صوتی
(۵۰) -
آموزشی ناب
(۱۲۲) -
سرگرمی
(۵۱) -
درسی
(۹) -
کتاب های آموزش ناب (ویژه)
(۳۰)
-
-
علوم پایه
(۲۸۰)-
شیمی
(۱۱۰) -
زیست شناسی
(۱۲) -
ریاضی , آمار
(۲۵) -
فیزیک
(۳۲) -
محیط زیست
(۴۵)
-
-
علوم انسانی
(۱۱۵۳)-
آموزش پرورش
(۸۳) -
زبان خارجه
(۱۷۵) -
علوم سیاسی
(۱۳) -
حقوق
(۱۹۲) -
اقتصاد
(۵۰) -
مدیریت
(۱۶۷) -
فلسفه
(۶۲) -
کارآموزی
(۹۱) -
حسابداری
(۶۴) -
علوم اجتماعی
(۱۴) -
روان شناسی
(۷۰) -
علوم تربیتی
(۲۸) -
باستان شناسی
(۴) -
علوم ارتباطات
(۷)
-
-
فنی و مهندسی
(۱۱۰۳)-
برق
(۱۲۷)-
مخابرات
(۷)
-
-
عمران
(۱۴۴) -
کشاورزی و منابع طبیعی
(۱۰۶) -
کامپیوتر
(۲۷۱) -
معماری
(۱۶۸) -
صنایع
(۴۱) -
مکانیک
(۱۱۴) -
مهندسی شیمی
(۱۶) -
سایر رشته های فنی مهندسی
(۳۴)
-
-
محصولات
(۹۴۷)-
آموزشی
(۲۱۷)-
مالتی مدیا
(۵۹)
-
-
محصولات سلامتی و پزشکی
(۱۶۷)-
آرایشی بهداشتی و زیبایی
(۴۸) -
عطر و ادکلن
(۸۵) -
لوازم پزشکی
(۱۸)
-
-
خرید محصولات خانگی
(۲۰۹)-
لوازم آشپزخانه
(۱۵۳) -
دکوارسیون
(۸) -
لوازم ضروری برای همه
(۱۸)
-
-
اسباب بازی
(۱۶) -
لوازم شخصی
(۹۲)-
عینک آفتابی،طبی
(۴۰) -
ساعت
(۴۵)
-
-
مد و پوشاک
(۱۶۹)-
لباس زنانه
(۴۲) -
لباس مردانه
(۲۴) -
کیف و کفش
(۹۲) -
لباس محرم
(۳) -
کلاه
(۵)
-
-
ورزش و سرگرمی
(۴۰) -
سایر محصولات
(۳۳)
-
-
آموزش های تصویری
(۴۴) -
عید نوروز1396
(۷) -
کتاب های آموزشی ناب
(۲۹) -
لوازم خودرو
(۴۱) -
گرافیک،هنر دیجیتال، میکس و مونتاژ فیلم
(۲۱۵) -
قالب و افزونه
(۴۲) -
مکمل های غذایی(ویژه)
(۳) -
لوازم شخصی
(۱۳۴)-
بهداشت و مراقبت
(۳۵) -
زیور آلات
(۹۷)
-
-
لوازم دیجیتال
(۱۵۸) -
پزشکی
(۱۱۶)-
پزشکی عمومی
(۱۱۴)
-
-
عمومی و آزاد
(۴۵۸) -
دانلودپرفروش های فورکیا
(۲۴۲۰) -
گزارش کارآموزی
(۲۳)
کلمات کلیدی
نسیم بوک
پرفروش های فورکیا#
تن ورز شاپ
فورکیا#
سیستم همکاری در فروش
فایل بایوس لپ تاپ#
نسیم بوک#
خرید دستبند
خرید گردنبند
خرید عینک آفتابی
خرید اینترنتی
معماری#
تن ورزشاپ#
همکاری در فروش می شاپ
سیستم همکاری در فروش می شاپ
دانلود طرح توجیهی فنی
خرید زیورآلات
خرید کفش
خرید کیف
معماری
خرید دستبند چرم
خرید اینترنتی مانتو
میهن استور
کسب درامد از اینترنت در هفت روز#
مقاله
خرید اینترنتی عینک
خرید اینترنتی کفش
خرید کیف زنانه
خرید کفش مردانه
خرید کفش ورزشی
محبوب ترین مطالب
- ۹۶/۰۵/۱۹اسپیکر بلوتوثی آنجل
- ۹۶/۰۶/۱۶پروژه بررسی سیستم های خبره
- ۹۶/۰۵/۲۸پکیج آموزش مشاورین املاک شماره یک
- ۹۶/۰۵/۲۹داستان های فرانسوی با ترجمه فارسی
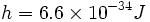 ، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.
، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.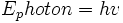
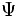 میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر
به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل
میپذیرد که چگالی احتمال برابر
میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر
به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل
میپذیرد که چگالی احتمال برابر  است.
است.